Revue d'Evidence-Based Medicine
Etudes d’équivalence versus études d’infériorité ou de supériorité
Formation médicale continue ~ Concepts et outils en EBM
| La rédaction consacre une rubrique ‘Formation médicale continue’ (FMC) à l’explicitation de concepts et outils en Evidence-Based Medicine (EBM). |
Conclure à une équivalence parfaite entre deux traitements est impossible pour les tests statistiques : la probabilité que la différence entre ceux-ci soit nulle… est nulle. Une équivalence peut cependant être acceptée si la différence observée est considérée comme négligeable au point de vue clinique, sans pour autant être nulle (1). Les études d’équivalence sont beaucoup plus rares que les études de supériorité ou de non infériorité, sauf dans un domaine particulier, les études de bioéquivalence (2).
Une étude d’équivalence évalue si la différence observée, avec son intervalle de confiance à 95%, est entièrement comprise entre les bornes d’équivalence déterminées.
Une borne d’équivalence (ΔC) résulte d’un consensus entre experts basé sur une étude de la littérature, de préférence une méta-analyse, si elle existe. Elle doit être inférieure à la borne de supériorité considérée comme notable et cliniquement pertinente ; une valeur représentant la moitié de la borne de supériorité est généralement choisie (1), parfois les deux tiers ; suivant le contexte, une fraction plus faible peut encore être choisie (un quart) (3).
Exemple : supposons des résultats de différentes études d’équivalence, avec un résultat pour un même critère primaire d’efficacité donné avec son intervalle de confiance. Le chiffre du résultat observé (= la différence entre les deux traitements) est représenté par un carré et l’intervalle de confiance (à 95%) de cette différence, par une ligne horizontale s’étendant de part et d’autre du carré. Observons les limites (bornes) de ces intervalles de confiance par rapport aux bornes d’équivalence ΔC déterminées. Pour qu’il y ait équivalence, les limites de l’intervalle de confiance ne doivent pas être « à l’extérieur » des bornes d’équivalence -DC et + DC.
Figure
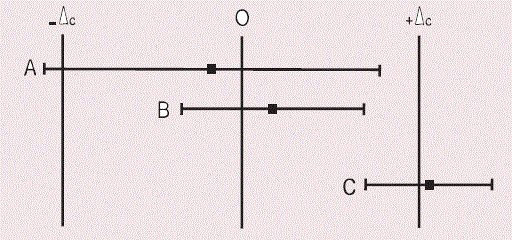
Dans le premier exemple (A), il n’est pas possible de conclure à l’équivalence entre les deux traitements.
Dans le deuxième exemple (B), une équivalence est observée.
Dans la troisième étude (C), il n’est pas possible de conclure à l’équivalence entre les deux traitements.
Exemple pratique (« Prednisolone pour la crise de goutte » dans ce même numéro (4))
Les auteurs concluent à une équivalence entre prednisolone et naproxène sur base du résultat pour la douleur (lors d’une crise de goutte) sur l’EVA de 100 mm : différence de 1,3 mm (IC à 95% de -9,8 à 7,1) avec une borne d’équivalence de 10 mm. Les limites de l’intervalle de confiance ne dépassant pas 10 mm, une équivalence est montrée… pour la borne choisie. Le choix de la borne est cependant purement arbitraire, inspiré par une autre étude sur la goutte dans laquelle une borne de supériorité de 13 mm est reprise … d’une autre étude sur la douleur post-traumatique avec une différence de 13 mm jugée comme pertinente d’une modification de la douleur avec IC à 95% de 10 à 17 mm. Ce choix de 10 mm pour une borne d’équivalence dans une étude sur la crise de goutte est donc très contestable : utilisation d’une borne de supériorité pour une douleur post-traumatique. Le choix classique d’une borne d’équivalence d’au moins la moitié d’une borne de supériorité, dans ce cas 13/2 ou, mieux 10/2, aurait été plus correct et aurait incité à conclure à une non équivalence (= étude A sur le graphique).
Différence avec une étude de non infériorité
Pour conclure à une équivalence, la différence observée doit être comprise, avec son intervalle de confiance, entre les bornes d’équivalence (négatives et positives).
Pour conclure à une non infériorité, la borne inférieure de l’intervalle de confiance des résultats observés doit être supérieure à la borne de non infériorité -DC fixée, autrement dit le traitement X peut être équivalent ou supérieur au traitement Y.
Pour une étude d’équivalence, il peut être pertinent pour les conclusions cliniques d’accepter une dissymétrie dans les bornes d’équivalence clinique pour la borne inférieure (-) et la borne supérieure (+) cette dernière pouvant être le double de l’autre.
Pour le calcul de la population à inclure dans une étude d’équivalence, il n’existe pas de formule explicite précise comme dans les études de non infériorité mais des formules sont proposées par des experts (3).
Supériorité, non infériorité, équivalence
L’absence d’une différence observée entre deux traitements dans une étude de supériorité peut-elle être interprétée comme une équivalence ou une non infériorité entre ces deux traitements ? La réponse est clairement non (4). Au point de vue méthodologique une absence de preuve de différence entre deux traitements ne veut pas dire que nous disposons de preuves de l’absence de différence (non infériorité) ou d’équivalence (différence négligeable, cliniquement non pertinente). Chacun de ces types d’étude requiert une méthodologie particulière, en particulier une analyse par protocole pour les études de non infériorité et d’équivalence, une analyse en intention de traiter pour les études de supériorité.
| Il n’est pas possible de résumer brièvement toutes les précautions à prendre dans l’interprétation de la valeur méthodologique et des résultats d’une analyse d’équivalence. Minerva s’efforce, dans l’analyse de ce type d’étude, d’en souligner tous les aspects utiles pour le clinicien. |
Références
- Jones B, Jarvis P, Lewis JA, Ebbutt AF. Trials to assess equivalence: the importance of rigorous methods. BMJ 1996;313(7048):36-9.
- Bogaert M, Chevalier P. Equivalence clinique des génériques. Personne à convaincre…MinervaF 2009;8(5):53.
- Grouin JM et Coste M. Essais de non infériorité et d’équivalence : méthodologie et analyse. In Essais cliniques : théorie, pratique et critique. Médecine-Sciences Editions Flammarion 2006.
- Poelman T. Prednisolone pour la crise de goutte ? MinervaF 2009;8(8):112-3.
- Gonzalez CD, Bolanos R, Sereday M. Editorial on hypothesis and objectives in clinical trials: superiority, equivalence and non-inferiority. Thromb J 2009;7:3.
Ajoutez un commentaire
Commentaires





