Revue d'Evidence-Based Medicine
Double aveugle et protocole ouvert : résultats différents ?
Formation médicale continue ~ Concepts et outils en EBM
| La rédaction consacre une rubrique ‘Formation médicale continue’ (FMC) à l’explicitation de concepts et outils en Evidence-Based Medicine (EBM) |
Aveugle ou non
Dans une étude en protocole ouvert, les patients inclus comme les chercheurs ou thérapeutes sont au courant du traitement réellement reçu (principe actif ou placebo, médicament A ou B).
Une recherche expérimentale est dite aveugle (en insu) si les personnes concernées ne sont pas au courant du traitement réellement administré. Si ce sont uniquement les chercheurs ou thérapeutes mais pas les patients qui connaissent le traitement réellement administré, il s’agit d’un simple aveugle. Si les sujets inclus comme les chercheurs ignorent le traitement, nous parlons d’un double aveugle. L’adjudication des événements à suivre peut également être faite (souvent de façon centrale dans ce cas) en insu du traitement reçu, méthodologie introduite en 1992 par Hansson (1) pour les études en protocole ouvert mais qui peut bien sûr être également utilisée dans les études en (double) aveugle. Si, en plus des patients et des chercheurs, les personnes qui analysent les résultats ne sont pas au courant du traitement réellement administré, nous parlons de triple aveugle.
Les résultats d’une recherche sont-ils influencés par le fait qu’elle se déroule en aveugle ou en ouvert ?
Aveugle et ampleur du résultat
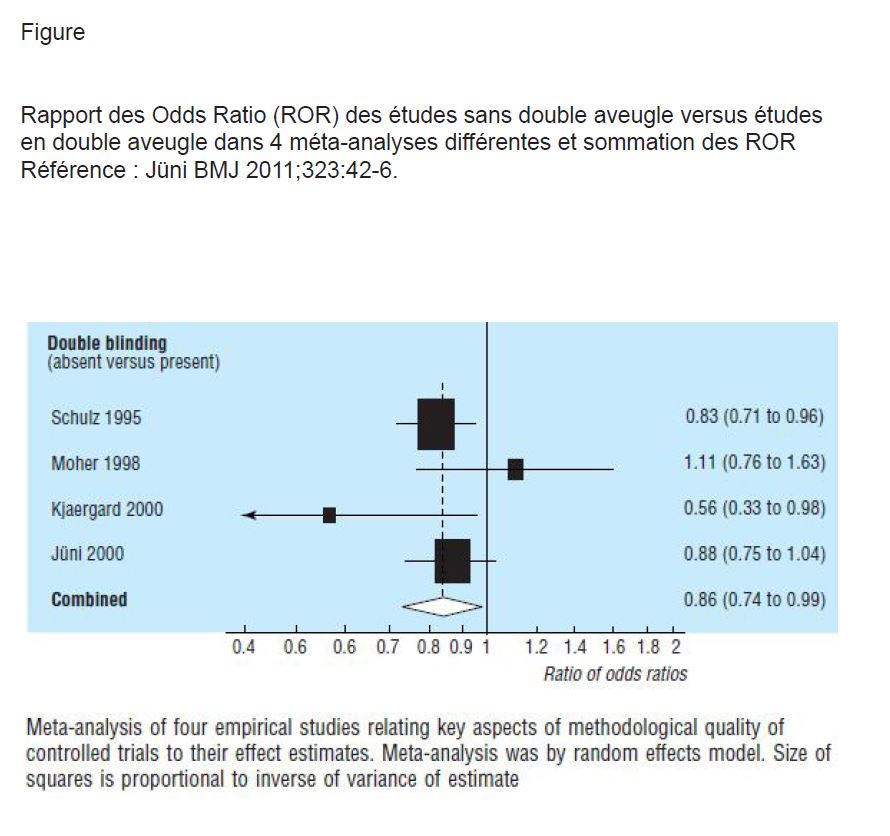
En 1995, Schultz (2) constatait que plusieurs éléments pouvaient modifier l’ampleur des résultats d’une étude : l’ampleur est plus grande dans les études en cas de secret d’attribution inadéquat ou non précisé, mais aussi en absence de double aveugle. Jüni en 2011 (3) analysait les résultats de 4 méta-analyses évaluant l’existence d’un biais lié à l’absence de double aveugle. Il donne un rapport des Odds Ratio (ROR) pour les résultats de chaque type d’études dans chaque méta-analyse, un ROR, notion déjà précédemment explicitée dans Minerva (4). Un ROR <1 indique que les RCTs non en double aveugle donnent une taille d’effet plus importante que les RCTs en double aveugle. Le ROR sommé des 4 méta-analyses est de 0,86 (IC à 95% de 0,74 à 0,99) (voir figure). En 2007, Bero (5) a analysé les résultats de 192 RCTs publiées comparant une statine à un autre médicament. Il montre, entre autres, en analyse multivariée, que les études avec aveugle adéquat (89 sur les 192) donnent des résultats moins favorables pour le médicament évalué et aussi moins souvent des résultats statistiquement significatifs en faveur du médicament testé pour les comparaisons entre statines : OR de 0,28 (IC à 95% de 0,11 à 0,73).
Aveugle et fiabilité du résultat
Plus récemment, Psaty (6) s’est intéressé aux résultats de l’étude RECORD (7,8) concernant la rosiglitazone. Nous avons déjà discuté de cette étude dans la revue Minerva lors de la présentation de la méta-analyse de Nissen (9,10) : cette méta-analyse montre un risque accru de survenue d’infarctus du myocarde et probablement de décès cardio-vasculaire chez des patients diabétiques de type 2 quand ils sont traités par rosiglitazone versus placebo ou autre antidiabétique oral. Par contre, l’étude RECORD, en protocole ouvert mais avec adjudication en aveugle des événements (hospitalisations, infarctus du myocarde), montre une non infériorité de la rosiglitazone versus metformine plus sulfamidé hypoglycémiant pour le critère primaire (hospitalisation pour motif cardiovasculaire ou décès) sans augmentation de risque d’infarctus du myocarde : HR 1,14 ; IC à 95% de 0,80 à 1,63. Le nombre d’événements dans le groupe contrôle est étonnamment bas. La synthèse indépendante des résultats de cette étude par un des experts de la FDA (11) apporte des éléments de débat fort intéressants. Cet expert a revu les événements rapportés (549 sur 2 220 patients). Il constate que l’insu lors de l’adjudication est en général bien respecté mais 70 cas posent problème, par non signalement d’événement, non envoi pour adjudication, information insuffisante ou problème d’adjudication. Les problèmes sont plus fréquents dans le groupe rosiglitazone (16,2%) que dans le groupe contrôle (9,2%). Pour ces cas problématiques, la décision est en faveur de la rosiglitazone dans 81% des cas et en faveur du groupe contrôle dans 19% des cas. Une réadjudication avec correction montre un HR d’infarctus du myocarde de 1,38 (IC à 95% de 0,99 à 1,93), résultat beaucoup plus proche de celui de la méta-analyse de Nissen.
Cet exemple illustre bien le danger d’une non communication sélective d’événements défavorables dans un protocole d’étude en ouvert ; dans ce cas de non communication, une adjudication centrale ne corrige en rien l’absence de double aveugle.
Conclusion
Les quelques exemples ci-dessus illustrent l’importance de l’insu dans une étude clinique, pour la fiabilité du résultat comme pour l’ampleur de celui-ci. Pour ce qui est de l’inflation de l’ampleur d’un résultat, cette absence d’insu est à ajouter à d’autres facteurs tels que le caractère uni ou multicentrique d’une étude (4), le nombre d’études et de patients dans une méta-analyse (12).
Références
- Hansson L, Hedner T, Dahlöf B. Prospective randomized open blinded end-point (PROBE) study: a novel design for intervention trials. Blood Press 1992;1:113-9.
- Schultz K, Chalmers I, Hayes R et al. Empirical evidence of bias. Dimensions of methodological quality associated with estimates of treatment effects in controlled trials. JAMA 1995;273:408-12.
- Jüni P, Altman DG, Egger M. Systematic reviews in health care. Assessing the quality of controlled clinical trials. BMJ 2011;323:42-6.
- Chevalier P. Etude uni ou multicentrique : efficacité thérapeutique différente ? MinervaF 2011;10(10):129.
- Bero L, Oostvogel F, Bacchetti P, Lee K. Factors associated with findings of published trials of drug-drug comparisons: why some statins appear more efficacious than others. PLoS Med 2007;4:e184.
- Psaty BM, Prentice RL. Minimizing bias in randomized trials: the importance of blinding. JAMA 2010;304:793-4.
- Home PD, Pocock SJ, Beck-Nielsen H, et al; RECORD Study Group. Rosiglitazone evaluated for cardiovascular outcomes: an interim analysis.N Engl J Med 2007;357:28-38.
- Home PD, Pocock SJ, Beck-Nielsen H, et al; RECORD Study Team. Rosiglitazone evaluated for cardiovascular outcomes in oral combination therapy for type 2 diabetes (RECORD): a multicentre, randomized, open-label trial. Lancet 2009;373:2125-35.
- Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007;356:2457-71.
- Chevalier P. Les risques cardio-vasculaires de la rosiglitazone. MinervaF 2007;6(9):136-7.
- Marciniak TA. Memorandum of June 14, 2010 on cardiovascular events in RECORD (NDA 21-071/S-035): FDA briefing document, pages 16-151.
- Chevalier P. Crédibilité et inflation de l’efficacité dans les méta-analyses. MinervaF 2012;11(1):12.
Ajoutez un commentaire
Commentaires