Tijdschrift voor Evidence-Based Medicine
Netwerk meta-analyses: directe en indirecte vergelijkingen
Nascholing: EBM begrippen
| In deze rubriek brengt de redactie korte teksten over gangbare begrippen in Evidence-Based Medicine (EBM). |
Gerandomiseerde, gecontroleerde studies (RCT) leveren het meest betrouwbare bewijs met de minste kans op vertekening. Wil men betrouwbare conclusies trekken uit de vergelijking van geneesmiddelen met eenzelfde indicatie, dan is alleen een RCT hiervoor het correcte onderzoeksdesign. Veel behandelingen voor eenzelfde indicatie vergelijkt men helaas niet onderling en indien wel, blijft de publicatie ervan soms uit.
Kunnen indirecte vergelijkingen het tekort aan directe vergelijkingen compenseren of het geringe aantal directe vergelijkingen aanvullen? Is het mogelijk om met voldoende statistische betrouwbaarheid (zonder vertekening) de resultaten van directe en indirecte vergelijkingen te groeperen, en dus gemengde vergelijkingen te creëren? Het concept van een netwerk meta-analyse wil aan deze doelstelling tegemoet komen. Aan welke elementaire criteria moet een netwerk meta-analyse voldoen om valide te zijn?
Directe en indirecte vergelijking
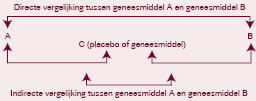
Een indirecte vergelijking kan op een ‘eenvoudige’ manier gebeuren: vergelijking van de resultaten van twee studies, van twee verschillende meta-analyses of van studie-armen uit verschillende onderzoeken. Deze manier van vergelijken leidt tot bias, die we kunnen vermijden door twee interventies te vergelijken die op hun beurt met eenzelfde interventie werden vergeleken (placebo of geneesmiddel C zoals in de volgende illustratie).
Er zijn daarnaast geavanceerdere technieken beschikbaar om indirecte vergelijkingen uit te voeren. Hierbij integreert men de kansverdeling van de te beoordelen parameter om zo met alle mogelijkheden rekening te kunnen houden. Deze technieken baseren zich op de Bayesiaanse Markov keten Monte Carlo (Markov chain Monte Carlo, MCMC)-methodes, maar met geavanceerdere cijferanalyses dan in de klassieke modellen.
Een Monte Carlo-methode is gebaseerd op een bestaande verdeling van een variabele, wat toelaat de meest waarschijnlijke schatting te bepalen. Een Markov model beschrijft de ziekteprogressie op basis van verschillende gezondheidstoestanden. Op vaste punten in de tijd worden, in functie van de ingestelde behandeling, de overgangen tussen ziektespecifieke toestanden berekend. Een andere methode is de klassieke meta-regressie (modellering van het vastgestelde effect met behulp van co-variabelen).
Gecorrigeerde indirecte vergelijking
Net zoals bij een meta-analyse van studies die geneesmiddel A met geneesmiddel B vergelijken, is het noodzakelijk dat de meta-analyses die A met C en B met C vergelijken homogeen zijn (dus niet heterogeen).
Om A en B te vergelijken, gebruik makend van C als comparator, is het ook noodzakelijk dat alle studies vergelijkbaar zijn (‘similarity’). Similariteit heeft betrekking op het klinische aspect (dezelfde kenmerken voor patiënten, interventies, studiecontext, follow-up en eindpunten) maar ook op het methodologische aspect (risico van bias in de studies) (1). Verschillende auteurs wijzen op de noodzaak om de methodes van indirecte vergelijkingen nog beter te onderzoeken (2).
Combinatie van directe en indirecte vergelijkingen
Andere methodes richten zich op alle beschikbare behandelingen voor eenzelfde indicatie en combineren hierbij indirecte en directe vergelijkingen. Hier gaat het dan over gemengde vergelijkingen of netwerk meta-analyses. Deze methodes kaderen in een Bayesiaanse aanpak en maken gebruik van de Markov keten Monte Carlo-technieken. Deze methode vereist ook dat men vooraf sommige parameterverdelingen specifieert (a priori verdeling).
Om valide te zijn moet deze methode toegepast worden op een netwerk van studies waarbij de homogeniteit en de similariteit verzekerd zijn, maar ook de consistentie (‘consistency’) van de gegevens. We spreken van inconsistentie (I²-test van Higgins) als er een verschil is tussen de resultaten van directe vergelijkingen en deze van indirecte vergelijkingen. Stel dat geneesmiddel B vergeleken werd met placebo C, dan zou geneesmiddel A ten opzichte van placebo C hetzelfde relatieve risico opleveren. Maar indien C in andere studies met A een actief product is, kan er sprake zijn van inconsistentie. Er mag dus geen inconsistentie zijn in de verschillende stappen waarmee A en B vergeleken worden (3). Deze verschillen kunnen te wijten zijn aan het toeval, aan het feit dat de indirecte vergelijkingen niet valide zijn, aan vertekening in de directe vergelijkingen of aan klinische heterogeniteit (1).
Elke vergelijking moet op consequente wijze voldoen aan de drie bovenvermelde elementen (homogeniteit, similariteit, consistentie): homogeniteit is noodzakelijk om de resultaten te groeperen; homogeniteit en similariteit zijn noodzakelijk voor een gecorrigeerde indirecte vergelijking; homogeniteit, similariteit en consistentie zijn noodzakelijk voor een gemengde vergelijking of voor het groeperen van resultaten van directe en indirecte vergelijkingen.
P. Chevalier, met de medewerking van F. Vrijens
- Song F, Loke YK, Walsh T, et al. Methodological problems in the use of indirect comparisons for evaluating healthcare interventions: survey of published systematic reviews. BMJ 2009;338:b1147.
- Glenny AM, Altman DG, Song F, et al; International Stroke Trial Collaborative Group. Indirect comparisons of competing interventions. Health Technol Assess 2005;9:1-134.
- Cucherat M. Comparaisons indirectes et méta-analyse en réseau. http://www.spc.univ-lypn1.fr/polycop/sommaire2.htm (geraadpleegd op 17/05/2009)
Auteurs
Chevalier P.
médecin généraliste
COI :
Woordenlijst
Bayesiaanse netwerk meta-analyseCodering
Commentaar
Commentaar





